Gliomes de haut grade
Les gliomes de haut grade (grades III et IV) sont des tumeurs malignes primitives du système nerveux central issues des cellules gliales. La plus fréquente chez l'adulte est le glioblastome multiforme (gliome de grade IV le plus agressif) dont l'incidence est de ≈ 5 cas/ 100.000 habitants/ an.
Malgré un potentiel métastatique extrêmement faible, leur pronostic vital est malheureusement encore sombre à court ou moyen terme, la médiane de survie avec traitement étant de 30 mois pour les grades III et de 15 mois pour les grades IV (survie à 5 ans de 4%).
Eléments d'histologie et d'oncogénèse
Si le diagnostic histologique de gliome de haut grade est généralement aisé (caractère glial confirmé par les anticorps GFAP, degré de malignité évalué selon les critères habituels : nombre de mitoses, noyaux anormaux, degré de nécrose, prolifération endothéliale), leurs classifications (classification histologique de l'Organisation Mondiale de la Santé [OMS] ou classification histo-radiologique de Sainte-Anne) restent imprécises et peu reproductibles. En outre, certains gliomes de grade III se rapprochent fort des gliomes de grade II (classiquement classés dans les gliomes de "bas grade" alors qu'ils sont également aujourd'hui considérés comme de véritables lésions malignes) de par leur évolution clinique plus favorable et leur aspect radiologique. L'avis de l'anatomo-pathologiste est donc à confronter aux résultats des imageries radiologiques et isotopiques.
Quoi qu'il en soit, l'OMS distingue les gliomes anaplasiques (grade III : astrocytomes, oligodendrogliomes et oligoastrocytomes anaplasiques) et les glioblastomes (grade IV).
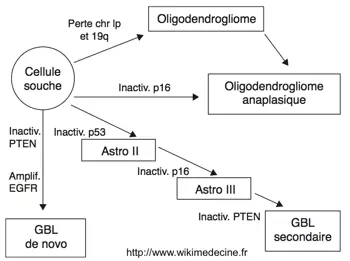
L'oncogénèse se caractérise par une prolifération de cellules gliales secondaire à la surexpression de proto-oncogènes et à la perte de suppresseurs de tumeurs. De nombreuse anomalies cytogénétiques ont été retrouvées (++ délétions 1p, 9p, 10, 13q, 17p, 19q, 22q et gains sur le chromosome 7) et leur nombre est corrélé à l'agressivité tumorale.
L'hypothèse historique selon laquelle les glioblastomes ne surviendraient que de novo a été abandonnée et il est désormais bien établi que les gliomes de grade II évoluent inexorablement vers un haut grade. On décrit actuellement trois grandes voies de progression à partir des cellules gliales :
- Voie des astrocytomes de grade II → III (astrocytome anaplasique) → IV (glioblastome secondaire)
- Les gliomes de grade II dégénèrent inéluctablement en grade III puis en grade IV au fur et à mesure d'accumulations d'altérations génétiques qui seraient caractérisées par des mutations précoces de p53 et une boucle autocrine PDGF/ PDGFR. Des mutations ou délétions de p16 et CDKN2A sont retrouvées dans les foyers anaplasiques. La progression vers un glioblastome serait liée à la survenue de délétions du chromosome 10 et l'hyperméthylation de régions promotrices de RB1 et MGMT.
- Voie des glioblastomes "de novo" = primaires
- Leur survenue serait caractérisée par l'amplification d'EGFR, la perte du chromosome 10, la mutation PTEN et l'amplification de MDM2. Les mutations p53 sont rares.
- Voie des oligodendrogliomes (grade II) → oligodendrogliomes anaplasiques
- Haute fréquence de la délétion hétérozygote de 1p et 19q, boucle autocrine PDGF/PDGFR. La dégénérescence anaplasique s'accompagnerait d'une perte de p16/CDKN2A, de 10q, de RB1 et p53 et d'une surexpression de EGFR
Hormis les facteurs génétiques, divers facteurs de risque professionnels (industrie du caoutchouc, plomb, pesticides) ont été incriminés sans qu'un lien de causalité direct n'ait pu être démontré. Tout comme pour les méningiomes, des cas de gliomes de haut grade radio-induits sont par contre bien établis.
Clinique
Les manifestations cliniques peuvent être :
- Dues à la lésion proprement dite (infiltration, compression, biais vasculaire)
- Crises épileptiques
- Déficits focaux variables selon la localisation et d'installation progressive
- Céphalées (étirement d'éléments vasculaires ou méningés)
- Dues à l'hypertension intracrânienne (HTIC)
- Céphalées (++ matinales, bilatérales, lancinantes, se renforçant aux changements de position ou au valsalva), nausées, vomissements, rarement baisse d'acuité visuelle sur oedème papillaire (plus fréquent chez l'enfant)
- Des répercussions systémiques
- Mécanisme incompris (troubles métaboliques et/ ou immunitaires ? fonctionnels ?)
- Asthénie, diminution de la libido, anxiété
Bien qu'ils puissent survenir à tout âge, les astrocytomes anaplasiques surviennent préférentiellement entre 25 et 34 ans, les gliobastomes de novo préférentiellement entre 65-74 ans.
Si l'on excepte les disséminations au sein du parenchyme cérébral et médullaire ou au liquide céphalo-rachidien (LCR) (gliomatose méningée, survenant dans 4 à 20% des cas), le potentiel métastatique de ces tumeurs est extrêmement faible. Des cas de métastases osseuses ou pleurales ont cependant été décrits.
Examens complémentaires
CT-scanner cérébral sans et avec PC
Il peut mettre en évidence des calcifications, des remaniements hémorragique, un effet de masse,… La lésion et l'œdème apparaissent généralement comme une plage hypodense. Une prise de contraste traduit une rupture de la barrière hémato-encéphalique (BHE). Le diagnostic différentiel est parfois difficile avec un accident vasculaire cérébral, une encéphalite, un abcès ou une métastase.
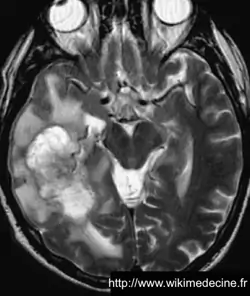
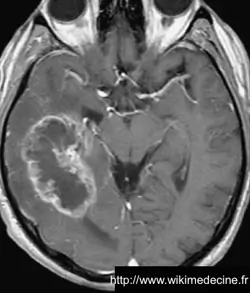
Résonance magnétique (IRM) cérébrale avec gadolinium (Gold Standard)
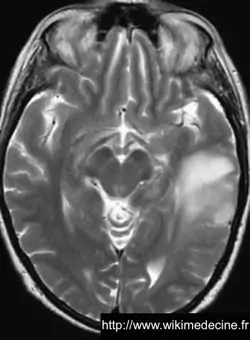
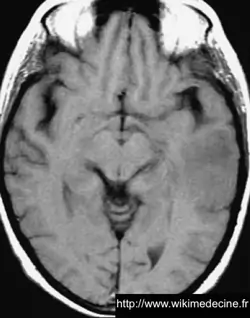
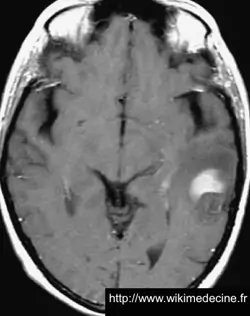
Dans les astrocytomes de grade III, on observe généralement un hyposignal diffus en T1 (lésion + œdème), des foyers prenant le gadolinium correspondant principalement aux zones de transformation anaplasique, un hypersignal diffus en FLAIR et T2.
Dans les glioblastomes, on observe généralement une volumineuse lésion très hétérogène hypointense en T1, prenant le contraste de façon souvent hétérogène (+ parfois prise de contraste annulaire) et hyperintense en T2, avec de multiples remaniements hémorragique, un volumineux œdème périlésionnel. Contrairement aux lymphomes et aux abcès, des plages nécrotiques sont typiquement fréquentes (hypersignaux T2 et FLAIR), la perfusion est augmentée (néo-vascularisation) et il n'y a généralement pas de restriction de diffusion (sensibilité et spécificité de 90%).
On observe parfois des lésions expansives de plus petites tailles à distance (gliomes multicentriques), d'une vaste nappe lésionnelle intéressant plusieurs lobes voire l'ensemble de l'encéphale (gliomatose cérébrale) ou une pachyméningite (gliomatose méningée).
|
|
|
Ponction lombaire
Sa place est ici très limitée. Elle peut présenter un intérêt en cas de pachyméningite → l'anatomo-pathologie du liquide céphalo-rachidien peut concourir au diagnostic différentiel (gliomatose méningée, sarcomatose méningée, pachyméningite métastatique, sarcoïdose, infections chroniques). Elle est néanmoins souvent contre-indiquée de par l'effet de masse tumoral (risque d'engagement par décompensation d'une HTIC).
Anatomo-pathologie : biopsie stéréotaxique ou pièce chirurgicale
Une confirmation anatomo-pathologique est indispensable pour l'établissement définitif du diagnostic. Elle peut se baser sur une biopsie ou directement sur le produit d'exérèse chirurgicale.
PET-scan cérébral
- A la méthionine
- ++ pour déterminer le degré de malignité de la tumeur
- Au FDG
- ++ pour guider une biopsie stéréotaxique (hot-spot), utile pour le diagnostic différentiel entre une récidive et une radionécrose, peut être utile pour le diagnostic différentiel avec un lymphome
SPECT-CT cérébral au MIBI
Principalement utilisé actuellement pour le diagnostic différentiel entre récidive et radionécrose.
Divers
Evaluation neuropsychologique systématique +- ophtalmologique. Discuter la réalisation d'autres examens selon le diagnostic différentiel établi.
Facteurs pronostiques
De façon générale, les facteurs de mauvais pronostic (évolution plus rapide) sont : âge > 45 ans, glioblastome multiforme, exérèse chirurgicale incomplète sur base radiologique, indice de performance faible.
Le pronostic sombre des gliomes de haut grade doit être tempéré par le fait qu'un allongement de survie plus important peut être obtenu dans certains rares cas : certains gliomes de grade III évoluent sur un mode similaire aux grade II (jusqu'à plusieurs décennies, l'aspect radiologique en est le meilleur facteur prédictif) et les tumeurs très superficielles peuvent permettre des exérèses chirurgicales optimales itératives.
Qualité de l'exérèse chirurgicale
Le bénéfice quant à la qualité de vie dépend de chaque cas selon l'expression clinique, la localisation et les risques iatrogènes. L'exérèse totale sur base macroscopique seule n'a démontré aucun bénéfice sur la durée de vie. Un bénéfice limité a par contre été démontré (++ 8 à 14 semaines) en cas d'exérèse optimale sur base IRM.
Le bénéfice est cependant parfois plus important pour des lésions de localisation superficielle permettant des exérèses itératives aisées → la chirurgie automatique est absurde et toujours à discuter au cas par cas. Le cas échéant, préférer l'exérèse de lésion sur base macroscopique + radiologique.
Principes thérapeutiques - Traitements
L'optique étant purement palliative, le bénéfice escompté en terme de survie doit être soigneusement pesé avec les répercussions en terme de qualité de vie. Chaque cas doit être discuté mais la prise en charge initiale la plus fréquente associe chirurgie, radiothérapie et chimiothérapie.
Chirurgie
Obtenir une guérison est illusoire : la "récidive" est inévitable quelque soit la qualité de l'exérèse. Trois objectifs sont possibles :
- Diagnostique : anatomo-pathologie diagnostique via biopsie ou exérèse – généralement indispensable pour définir la suite du traitement et éliminer avec certitude un diagnostic différentiel potentiellement curable
- Augmenter la survie et/ ou soulager des symptômes: réduction du volume tumoral, évacuation d'un contenu kystique, libération ou dérivation du liquide céphalo-rachidien
- Potentialiser l'effet des traitements adjuvants : exérèse des zones peu vascularisées, plus résistantes aux chimiothérapie et radiothérapie
L'exérèse totale sur base radiologique per-op est à préférer. Il faut cependant mettre en balance le bénéfice réduit sur la durée de vie avec les complications post-opératoires possibles selon la localisation. Toute intervention doit donc être soigneusement discutée.
Radiothérapie
Augmente la médiane de survie de toutes les néoplasies cérébrales (globalement, le gain de survie est estimé à 3 mois pour les gliomes de haut grade). La radiothérapie conventionnelle reste le Gold Standard. Le gamma-knife peut être discuté au cas par cas.
Dans les semaines qui suivent, une aggravation transitoire peut être observée (œdème). Une corticothérapie peut alors être utile. A plus d'un mois, une détérioration neurologique peut s'observer (démyélinisation), généralement transitoire et sans traitement possible. A plus de 4 mois, on peut rencontrer une radionécrose, une atrophie cérébrale ou des troubles de l'axe hypothalamo-hypophysaire. Les encéphalopathies post-radiques sont généralement trop tardives pour pouvoir être rencontrées dans un tel contexte.
Chimiothérapie
Augmente la médiane de survie de ≈ 2 mois. Pas de différence démontrée entre la chimiothérapie PO, IV ou locale per-op. Pas de consensus sur le moment pour l'initier (le plus rapidement possible ? à réserver pour les récidives ?). Les molécules ayant démontré une efficacité sont : BCNU, CCNU, fotémustine, cisplatine, carboplatine, procarbazine, étoposide, cyclophosphamide, hydroxy-urée, bléomycine, témozolomide (++ en première ligne). Des implants de carmustine peuvent également être utilisés.
Pas de consensus sur les protocoles mais en voici un qui a démontré son efficacité : témozolomide PO 75 mg/ m2/ jour 1 heure avant chaque irradiation durant la radiothérapie, traitement adjuvant un mois post-radiothérapie de 150 mg/ m2/ jour durant 5 jours tous les 28 jours (200 mg/ m2/ jour à partir de la deuxième cure). Prophylaxie anti-pneumocystis a assurer durant la cure (ex : trimethoprim/ sulfamethoxazole 800/ 160 mg 3 x/ semaine).
Divers
Diverses approches, non encore validées, sont en évaluation : agents anti-angiogéniques, agents modifiants les boucles auto et paracrines, immunomodulateurs. En urgence et en cas de volumineux œdème tumoral, une corticothérapie peut avoir un effet transitoire spectaculaire (! à éviter au maximum tant que le diagnostic différentiel de lymphome n'est pas écarté).
Un traitement anti-épileptique est à instaurer définitivement en cas de survenue d'une crise. Il n'y a par contre pas d'indication de traitement prophylactique (bien qu'un traitement anti-épileptique soit parfois instauré transitoirement [1 à 3 mois] en post-opératoire... il n'y a pas d'evidence soutenant cette attitude). Concernant les glioblastomes, la potentialisation de l'effet du temozolomide par le valproate est évoquée depuis plusieurs années... sans qu'un bénéfice en termes de survie ait été démontré.
Auteur(s)
Shanan Khairi, MD
Bibliographie
Batchelor T et al., Management of recurrent high grade gliomas, UpToDate, 2018
Bradley WG et al., Neurology in clinical practice, 5th ed., Butterworth-Heinemann, e-dition, 2007
Chatel M et al., Gliomes de haut grade, Encyclopédie Médico-Chirurgicale, Neurologie, Elsevier, Paris, 2005
Dietrich J et al., Clinical presentation, initial surgical approach, and prognosis of high grade gliomas, UpToDate, 2018
Osborn AG, Diagnostic imaging : brain, Amirsys, USA, 2d ed., 2009