Anémies hémolytiques
Les anémies hémolytiques résultent d'une diminution de la durée de vie des globules rouges (norme : 110 à 120 jours chez l'adulte). Elles sont généralement d'installation rapide.
Etablir l'anémie hémolytique
L'anémie est définie par une concentration sérique en hémoglobine (Hb) inférieure à 13 g/ dl chez l'homme et à 12 g/ dl chez la femme et l'enfant.
L'hémolyse peut-être établie par un taux de réticulocytes (globules rouges immatures) augmenté
- en l'absence d'autre cause (hémorragies récentes, régénération d'une anémie centrale)
- et/ ou une augmentation de la bilirubine non conjuguée (ou indirecte) et une haptoglobine diminuée (sensibilité de 92%, spécificité de 90%)
- et/ ou la mise en évidence d'anomalies structurelles des globules rouges au frottis sanguin.
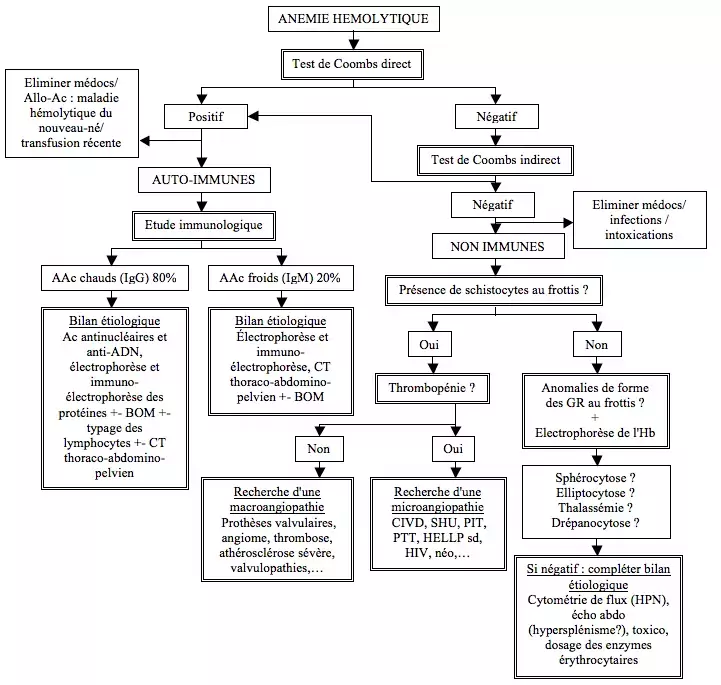
Exemple d'algorithme d'orientation étiologique
On peut retrouver dans toute anémie hémolytique
- Signes cliniques : signes généraux d'anémie, splénomégalie, ictère
- Plus souvent retrouvés en cas d'hémolyse aiguë intra-vasculaire : malaise intense, fièvre, frissons, céphalées, vomissements, douleurs lombaires et abdominales, pâleur intense, état de choc, urines raréfiée de couleur porto
- Signes biologiques : anémie le plus souvent normocytaire ou légèrement macrocytaire, hyperréticulocytose, haptoglobine effondrée, bilirubine libre élevée, LDH élevées
- Plus souvent en cas d'hémolyse aiguë intravasculaire : hémoglobinémie élevée, hémoglobinurie, microsphérocytes au frottis sanguin
Face à une anémie hémolytique, le premier examen d'orientation sera un test de Coombs (test à l'antiglobuline mettant en évidence des anticorps spécifiques, direct [TDA] ou indirect [TIA]) afin de distinguer hémolyses immunes et hémolyses non immunes.
En cas d'anémie hémolytique immune, on réalisera une étude immunologique, un bilan auto-immun, une électrophorèse et une immuno-électrophorèse des protéines. Selon les cas pourront également être réalisés un typage lymphocytaire, un CT-scanner thoraco-abdomino-pelvien ou une biopsie ostéo-médullaire (BOM).
En cas d'anémie hémolytique non auto-immune, on réalisera à minima un frottis sanguin. D'autres examens (bilan auto-immun, examens radiologiques, cytométrie,...) sont à évaluer au cas par cas.
Anémies hémolytiques auto-immunes (AHAI)
Anémies hémolytiques acquises d'origine extra-corpusculaire. Elles sont rares, de pronostic médiocre et peuvent s'observer à tout âge. Leur diagnostic repose sur la mise en évidence d'une hémolyse et la présence d'auto-Ac.
Tests diagnostiques
En cas de positivité de ces tests, il faudra typer les Auto-Ac mis en évidence.
- Test de Coombs direct = Test direct à l'antiglobuline (TDA)
- Examen fondamental consistant en la mise en contact de GR préalablement lavés avec des Ac monoclononaux spécifiques anti-IgG, anti-C3, anti-IgA et anti-IgM. Le test est positif en cas d'agglutination, démontrant une incompatibilité fœto-maternelle, une réaction post-transfusionnelle ou une AHAI.
- Test de Coombs indirect = Test indirect à l'antiglobuline (TIA)
- Examen moins sensible et spécifique que le TDA mais utile en cas de haute suspicion d'AHAI à TDA négatif. Consiste en la mise en évidence d'Ac circulants non agglutinants par mise en contact du sérum du patient avec des GR tests → lavage des GR → incubation en présence d'une antiglobuline. Le test est positif en cas d'agglutination.
AHAI à auto-anticorps chauds (AHAIc)
Se manifestent principalement par des signes d'hémolyse extra-vasculaire.
Etiologies
- AHAIc médicamenteuses ou post-infectieuses
- Evolution de règle favorable en quelques semaines après retrait du médicament ou résolution de l'infection
- AHAIc secondaires à une maladie systémique
- Pronostic conditionné par l'évolution de la maladie sous-jacente (LED, lymphomes NH,...)
- Le traitement associe une prise en charge symptomatique, étiologique et éventuellement une corticothérapie
- AHAIc idiopathiques
- Evolution chronique, mortalité globale de 5 à 20% (ischémie myocardique chez les personnes âgées, risque accru de TVP, complications infectieuses dues au traitement)
- !! un lymphome ou une myélodysplasie peuvent apparaître jusqu'à 4 ans après le diagnostic d'une AHAIc "idiopathique"
- Le traitement associe une prise en charge symptomatique (!!! surveillance étroite en cas de transfusions : apparition d'allo-Ac ?) et une corticothérapie :
- commencer par 1mg/ kg/ j d'équivalent prednisone durant 3 à 4 semaines puis réévaluer :
- si réponse : continuer à doses progressivement dégressives jusqu'à 4 à 12 mois après obtention d'une rémission.
- si pas de réponse (20%) : envisager une corticothérapie IV (bolus de 500 à 1000mg/ j durant 3 jours), l'administration d'Ig IV (rituximab), une splénectomie (principalement pour les personnes âgées tolérant mal une immunodépression) ou des immunosuppresseurs (à réserver en cas d'échec de tous les autres traitements)
- commencer par 1mg/ kg/ j d'équivalent prednisone durant 3 à 4 semaines puis réévaluer :
- Le syndrome d'Evans est défini comme l'association d'une AHAI et d'un PTI (+- neutropénie auto-immune)
- Très rare (0,3 à 2% des PTI de l'adulte)
- Idiopathique ou secondaire
Bilan étiologique
En dehors d'une étiologie évidente, on réalisera un bilan à la recherche d'une maladie primaire :
- FAN, ANCA, Ac anticardiolipides et recherche d'un anticoagulant circulant de type lupique
- Electrophorèse + immunoélectrophorèse des protéines
- Phénotypage des lymphocytes circulants en cas d'hyperlymphocytose
- Eventuellement : CT-scanner thoraco-abdomino-pelvien, PET-CT
- Biopsie ostéo-médullaire en cas d'hypogammaglobulinémie et/ ou présence d'Ig monoclonales et/ ou d'adénopathies profondes au CT
AHAI à auto-anticorps froids (AHAIf)
Se caractérisent généralement par un TDA positif de type complément (C3). Se manifestent principalement par des signes d'hémolyse extra-vasculaire. Possible manifestations d'acrosyndromes.
- AHAIf aiguës transitoires post-infectieuses (mononucléose infectieuse, primo-infection au CMV, hépatites, oreillons, HIV, mycoplasme, listéria, légionelles,…)
- Hémoglobinurie paroxystique a frigore
- Exceptionnelle chez l'adulte (syphillis tertiaire++)
- Traitement quasi-purement symptomatique. Intérêt modéré de l'éculizumab…
- Maladie des agglutinines froides (MAF)
- Forme chronique de l'adulte de plus de 50 ans
- Représente 10 à 20% des AHAI de l'adulte, 1 cas/ million d'hab/ an
- Associée dans 90% des cas à une IgM k monoclonale de faible intensité
- Etiologies :
- Idiopathique
- Secondaire : hémopathies (lymphome NH, LLC, Waldenström), cirrhose,…
- Généralement résistante à la corticothérapie ou la splénectomie. L'utilité du chlorambucil, du rituximab et d'autres biothérapies est toujours discutée…
- Traitement : symptomatique et éviction/ se protéger du froid
Autres anémies hémolytiques immunes
Allo-immunisation transfusionnelle
Résulte de la présence dans le plasma du receveur d'anticorps dirigés contre les antigènes des globules rouges transfusés. L'incompatibilité ABO est la première cause d'accidents transfusionnels mortels.
La clinique est variable :
- Inefficacité transfusionnelle
- Ictère post-transfusionnel sur hémolyse extravasculaire
- Hémolyse aiguë avec symptômes d'hémolyse intravasculaire : frissons, fièvre, lombalgies, hémoglobinurie, choc, IRA, CIVD,…
Traitement : arrêt des transfusions et supportif.
Anémies hémolytiques immuno-allergiques
Elles résultent de la formation d'auto-anticorps consécutive à une prise médicamenteuse :
- TCD de type IgG : ampicilline, céphalosporines, cisplatine, érythromycine, pénicilline, streptomycine, tétracyclines, tircacilline,…
- TCD de type complément : céfotaxime, ceftazidime, chlorambucil, chrlopromazine, hydralazine, phénacétine, quinine et dérivés, rifampicine, streptomycine, sulindac, tolbutamide,…
L'hémolyse débute généralement brutalement après la prise d'une dose et cesse rapidement à l'arrêt.
Anémies hémolytiques non immunes (AHNI)
Face à une AHNI, la première démarche consistera à éliminer :
- Infections : ++ malaria et septicémies bactériennes → goutte épaisse + hémocultures au moindre doute
- Intoxications : saturnisme, agents oxydants, venins de serpents et insectes
- Causes médicamenteuses
Ces causes exclues, un frottis sanguin permettra de s'orienter.
AHNI par fragmentation (présence de schizocytes au frottis sanguin)
Microangiopathies thrombotiques
Elles associent une anémie hémolytique mécanique (schistocytes), d'une thrombopénie et de lésions thrombotiques des petits vaisseaux.
- Le PTT = Purpura thrombotique thrombocytopénique
- Diagnostic à affirmer devant : AH mécanique + thrombopénie + fièvre + atteinte du système nerveux central + atteinte rénale
- Le SHU = Syndrome hémolyse-urémie
- Quasi exclusivement chez l'enfant après une infection à E coli 0157:H7
- Précédé de fièvre et signes digestifs, début brutal avec pâleur + ictère + syndrome hémorragique + IRA.
- L'IRA conditionne le pronostic. Le traitement est purement supportif.
Macroangiopathies
- Fragmentation intracardiaque
- Concerne les prothèses valvulaires (++ mécaniques) >>> valvulopathies non opérées
AHNI sans fragmentation
Hémoglobinurie paroxystique nocturne (rare)
Affection clonale acquise de la cellule souche hématopoïétique caractérisée par une hémolyse intravasculaire, avec svt exacerbation nocturne, une pancytopénie et un risque accru de thromboses veineuses. Affection chronique de traitement difficile (symptomatique +- allogreffe de moelle).
Hémoglobinopathies héréditaires
(envisager splénectomie en cas d'hypersplénisme)
- Drépanocytose (anémie falciforme, autosomique récessive)
- C'est la plus fréquente des hémoglobinopathies. Elle résulte de la mutation de la chaîne β de la globine > HbS, la désoxy-HbS étant capable de se polymériser in vivo → déformation des globules rouges en faux avec capacité d'adhésion accrue à l'endothélium (risque vaso-occlusif microcirculatoire) dans certaines circonstances (hyperthermie, acidose, déshydratation, hypoxie, IR,…)
- Homozygotes = malades, hétérozygotes = généralement porteurs sains
- Spécifique des patients noirs
- Chez le petit enfant : risque = ++ anémie, infections, crises douloureuses osseuses, séquestration splénique, AVC ischémiques
- Chez l'ado et l'adulte : risque = ++ complications viscérales dégénératives (glomérulopathie interstitielle, cirrhose sur hémochromatose ou HCV, rétinopathies, nécroses de hanche et tête humérale, HTAP, AVC)
- Principales complications vaso-occlusives aiguës :
- Crise vaso-occlusive osseuse simple
- Douleurs osseuses intenses +- t°, hyperPNN, hyperLDH
- Traitement : repos au chaud, hyperhydratation, alcalanisation, paracétamol +- codéine ou morphiniques, apport systématique de folates
- En cas de crise très sévère : envisager un échange transfusionnel partiel (saignée + transfusion de concentrés de GR pour diminuer le taux d'HbS) si Hb pas trop abaissée, sinon transfusions classiques, envisager hydroxyurée dans les cas les plus sévères
- Crises vaso-occlusives compliquées (risque vital)
- → immédiatement idem + envisager échanges transfusionnels rapides
- Priapisme grave : risque de nécrose des corps caverneux
- Syndrome thoracique aigu = symptômes thoraciques (dyspnée/ douleur/ toux) + infiltrat radiologique + fièvre → envisager nécessité USI/ VM
- AVC, rares chez l'adulte → CT au moindre doute
- Syndrome douloureux abdominal, rares chez l'adulte < ischémie mésentérique, infarctus/ séquestration splénique ou hépatique, cholécystite, angiocholite, pancréatite, pyélonéphrites
- Aggravation brutale et sévère de l'anémie → toujours rechercher une splénomégalie (séquestration splénique ?? → urgence vitale)
- β-thalassémies (++ africains, méditérannée, Inde, Asie du Sud-Est)
- Crise vaso-occlusive osseuse simple
- β-thalassémies mineures (hétérozygotes)
- → svt microcytose sans anémie importante, très rarement symptomatique, à détecter pour poser l'indication d'un conseil génétique
- β-thalassémies intermédiaires et majeures
- → hématopoïèse inefficace avec hématopoïèse extra-médullaire, déformations osseuses (faciès mongoloïde et épaississement de la voûte crânienne), hyperabsorption du fer, splénomégalie
- → ++ révélée dans la petite enfance par anémie sévère avec DEG
- Pronostic sévère, surtout lié à la surcharge en fer (cardiopathie hypertrophique et dilatée, cirrhose hépatique, poly-endocrinopathies)
- α-thalassémies(++ Asie du Sud-Est)
- semblables aux β-thalassémies mineures si 1/ 2 gènes atteints
- semblables aux β-thalassémies intermédiaires si 3 gènes atteints = hémoglobinose H
- généralement létale in-utéro si 4 gène atteints
Anémies hémolytiques héréditaires par anomalies membranaires (très rares)
- Sphérocytose héréditaire = maladie de Minkowski et Chauffard
- Autosomique dominante dans 70%, mutation de protéines du squelette sous-membranaire (++ ankyrine/ bande 3) → élimination progressive des fragments membranaires anormaux danss la rate → diminution de la surface du GR qui acquiert une forme sphérique et devient non déformable
- Détectée ++ durant l'enfance : subictère, fatigabilité.
- Cependant la maladie peut rester longtemps compensée et ne se révéler qu'à l'occasion de complications :
- "Crises de déglobulisation" (souvent liée à une anémie virale surajoutée)
- Lithiase vésiculaire précoce
- Tuméfaction indiquant une hématopoïèse extramédullaire
- Cependant la maladie peut rester longtemps compensée et ne se révéler qu'à l'occasion de complications :
- Suggérée par les atcdts familiaux et sphérocytes au frottis. Diag de certitude : diminution de résistance osmotique des GR dans une solution hypotonique et autohémolyse excessive invitro
- Autres : elliptocytose, stomatocytose, poïkilocytose héréditaire, acanthocytose
AH héréditaires par déficit enzymatique (très rares)
- Déficit en G6PD (chr X)
- → altération du potentiel d'oxydorécution cellulaire → évolution par poussées d'hémolyse svt secondaires à des prises alimentaires (ex classique: favisme)/ médicamenteuses (antipaludéens, sulfamides antibactériens,…) ou une virose
- Evocateur mais inconstant : corps de Heinz dans les GR. Diag de certitude : dosage direct enzymatique.
- Déficit en pyruvate-kinase (autosomique récessif)
- Diagnostic de certitude par dosage direct enzymatique
- Autres (exceptionnels, généralement autosomiques récessifs)
Auteur(s)
Dr Shanan Khairi, MD
Bibliographie
Barcellini W, Diagnosis of hemolytic anemia in adults, Uptodate, 2022
EMC, Biologie clinique, Elsevier, 2018
EMC, Traité AKOS, Elsevier, 2018
Means RT, Diagnostic approach to anemia in adults, Uptodate, 2022